
A VÍZÖNELLÁTÓ honlapon olvasható fejezetekben néha utalás van bizonyos tudományos elemekre, mint pl. az rH2. Ezeknek az ismerete a mondanivaló megértéséhez nem feltétlenül szükséges, bár számos levelezőm érdeklődött irántuk. Ezt az hiányosságot hivatott az itt közölt szöveg betölteni.
Szakemberek számára az itt kifejtett elemek annál is inkább érdekesek, mert nemcsak az rH2 fogalmát tartalmazzák, hanem a sav-bázis és redoxi reakciók teljesen újszerű egyesített elméletét is. Az itt leírt fogalmak teljes megértéséhez kémiából legalább érettségi színvonalú ismeretek szükségesek, bár a szakmában jártas tudósok is találnak benne valamit: egy ismert témakör teljesen új megvilágítását. A fejezet áttanulmányozását különösen bölcsészeti karokon tanuló, jövendőbeli kémia- és fizika tanároknak ajánlom. Az « életető víz » fogalmának a tudományos alapjait is itt lehet megismerni.
Sem az rH2 fogalma, sem a redox és a sav-bázis reakciók egyesített elmélete nem szerepel a kémia oktatás tantervében. Ezeket a fogalmakat a szakemberek túlnyomó többsége sem ismeri. Sajnos ennek hiányában a vizes oldatokban lejátszódó töltésátviteli reakciók helyes elemzése nehézkes és gyakran hibákhoz vezet.
Az itt leírt fogalmak képezik a bioelektronika tudományos alapjait. Vízzel (fordított ozmózissal) foglalkozó kereskedelmi körökben gyakran esik szó a Vincent-elméletről, amiről Magyarországon – bizonyos vízzel foglalkozó körökben – egyre többet beszélnek. A lúgos-, hidrogénezett és az un. « ionizált » vizek hívei ebben a fejezetben találják meg azokat a tudományos alapokat, amelyek segítségével ezeket a technikákat helyesen tudják értékelni. Az itt közölt tudományos elemek segítségével a különböző vízszűrő készülékeket gyártó szakemberek és értékesítő kereskedők ügyfeleiknek megbízható és tárgyilagos információkat adhatnak.
A bioelektronika vázlatos ismerete már olyan jelenségek megértéséhez is hozzájárul, mint néhány igen súlyos betegség (rák, vírusos betegségek, csontritkulás, szklerózis multiplex) megjelenési okai. Nyitott és rugalmas hozzáállású orvosok számára ezek az ismeretek új kutatási lehetőségeket tartalmaznak.
Az itt közölt szöveg nem más, mint Országh József 1990-91-ben Sciences du Vivant c. folyóiratban (Éditions Arys, Paris) megjelent két tudományos dolgozatának a rövid és könnyített összefoglalása.
-Réactions oxydo-réduction et acido-basique: vers une approche théorique et expérimentale plus cohérente. V.1, p.23-34 (1990)
-L'eau en tant que système redox. V.2, p.81-97 (1991)
Ez a szöveg először a www.eautarcie.org honlapon jelent meg francia nyelven, 2011-03-01
Magyar nyelven egy összefoglaló: a www.eautarcie.org/hu/03e2.html oldalon olvasható.
A magyar változat megjelenési dátuma: 2011-03-28
Frissítve: 2015-07-27


A redoxi és sav-bázis reakciók egységes elmélete – az ORP és az rH2 fogalma

Elektromos töltésátviteli folyamatok vizes közegben
Az alábbiakban leírt fogalmak csak vizes közegben érvényesek. Sok, vízzel foglalkozó szakember, az összes ismert folyadéktól merőben eltérő tulajdonságok ismeretében a vizet, mint a « természet csodáját » említi. Ezekhez, a vízben történő elektromos töltések, mint a proton (H+ pozitív elektromos töltés) és az elektron (e– negatív töltés) átvitele és rendhagyó vándorlása, nagyban hozzájárul. Az előbbiekhez kapcsolódnak a sav-bázis, az utóbbiakhoz pedig az oxido-redukciós (redoxi) reakciók. Minden általános kémiai kézikönyvben ezt a két reakciócsoportot, két különböző fejezet tárgyalja. Itt, már bevezetőben felhívjuk az olvasó figyelmét arra, hogy mindkét reakciócsoport tulajdonképpen elektromos töltések átvitelével történik. Nem meglepő tehát az a tény, hogy ezeket a reakciókat egy egységes elmélettel és hasonló matematikai összefüggésekkel lehet leírni. Az egyesített elmélet olyan összefüggésekre mutat rá, amit a szokásos közelítés egyrészt nem ismer, másrészt az egységes elmélet ismeretének hiánya hibás következtetések forrása lehet.
Megjegyzés. Ez a rész minden középiskolai tanuló előtt már elvileg ismert anyag. A képletek írásmódjának az ismeretére, elolvasása ennek ellenére – hasznos.
Egy vízmolekula egyik protonját H+ a szomszédos molekulának « átadhatja ». Ezt az átvitelt nevezik « autoprotolízisnek ». A folyamatot a következő egyenlettel lehet leírni:
Az írás egyszerűsítésére, a vegyészek a keletkezett « hidroxonium » iont H3O+ csak H+ formájában írják le. H3O+ tulajdonképpen nem más mint hidrolizált proton (amit nem szabad az előző fejezetben « hidranionnal » H3O– összetéveszteni). A valóságban egyetlen elektromos töltés, sem a proton H+, sem az elektron e– szabadon a vízben nem létezhet. Az írást egyszerűsítve, a protonátvitelt így írhatjuk le:
A protonját vesztett vízmolekula hidroxid ionná OH– alakul. Ennek a reakciónak (1) az egyensúlyi állandója (ill. ionszorzata) Kw a következő egyenlettel fejezhető ki :
...ahol [H+] és [OH–] a proton és a hidroxid ionok aktivitása. Első közelítésre [H+] és [OH–] az említett ionok koncentrációja amit mol/liter-ben fejeznek ki. Elektrokémiában és termodinamikában koncentráció helyett inkább aktivitásról szoktak beszélni. A matematikai képletekben az aktivitás egy dimenzió nélküli szám – tehát mértékegysége nem mol/liter.
Vízben feloldva, a savak protonokat H+ szabadítanak fel, ezzel a protonaktivitást [H+] növelik. A bázisok protonokat vonnak el a vízből, aminek a következménye a hidroxid ionok aktivitásának [OH–] a növekedése. A (2) egyenlet szerint a protonok és a hidroxid ionok aktivitásának a szorzata állandó és egyenlő Kw = 10-14-el. A H+ és az OH– ionok aktivitása egy mérleg serpenyőjéhez hasonlítható, amikor az egyik növekedik, a másik csökken és viszont.
Vizes oldatok savas és bázikus jellegének a mérésére, 1913-ban Sørensen a pH fogalmát vezette be, amit a következő módon határozott meg : pH = -log[H+]. Ezzel párhuzamosan a pOH fogalmát is bevezették, ami nem más, mint pOH = -log[OH–]. A két bevezetett logaritmusos fogalomhoz hasonlóan az autoprotolízis egyensúlyi állandóját Kw–t is logaritmikus formában fejezik ki : pKw = -logKw = -log10-14 = 14. Ezt figyelembe véve, a (2)-es egyenletet is logaritmikus formában lehet leírni:
Termodinamikában és elektrokémiában a vizes oldatok referencia (alap-) állapota a vegytiszta víz amiben a savas és a bázikus tulajdonság egyensúlyban van. Azt mondjuk, hogy az ilyen oldat semleges. Ekkor a protonok és a hidroxid ionok aktivitása egyenlő : [H+] = [OH–] = 10-7. Ebben az esetben pH=-log10-7=7. A pH=7 értéket, sav-bázis semlegességi pontnak nevezik. Olyan vizes oldatokat, amelyekben a pH, 0 és 7 között van, savas közegnek, olyanokat, amelyekben a pH 7 és 14 között helyezkedik el, bázikus (lúgos) közegnek nevezzük [1].
Olyan oldatokat, amelyeknek a pH értéke negatív « szupersavas » oldatoknak nevezik. Ezekben az oldatokban a protonaktivitás [H+]>1. Hasonlóan, « szuperbázikus » oldatokban pH>14. Itt [OH–]>1. Biológiában ilyen vizes oldatokkal nem találkozunk.
Az eddig leírt fogalmakat minden érettségizett középiskolás ismeri. Ezzel szemben az alábbi gondolatok a szakemberek számára is tartogatnak számos újdonságot.
Amint azt már említettük, a vizes oldatok termodinamikájában a referencia (alap-) állapot a vegytiszta víz, aminek a standard keletkezési reakciója a következő:
Ennek a reakciónak a termodinamikai függvényeit (entalpia, entrópia, szabad entalpia, hőkapacitás, stb.) termokémiai és elektrokémiai mérések alapján számítják ki. A víz standard keletkezési reakciójának a megfordításával jön létre az « autoelektrolízisnek » nevezhető reakció. Amint az autoprotolízis folyamán protonok, az autoelektrolízis folyamán elektronok cserélnek helyet. Ez utóbbi, négy elektron e–, két vízmolekula között történő átvitelével, jön létre. Az eredmény : két hidrogén H2 és egy oxigén O2 molekula « születése »:
(Megjegyzés: a proton- és elektroncserés reakciók közötti párhuzam nagyon szembetűnő.) Az (5)-ös reakció Ke egyensúlyi állandója:
Egy vízmolekula oxigénje egy-egy elektront ad át két hidrogén atomnak. Ez utóbbiak hidrogén molekulává H2 egyesülnek. Az elektronjaitól « megfosztott » oxigén egy másik, hasonló helyzetben lévő oxigén atommal egyesül és egy oxigén molekula O2 keletkezik [2]. Az autoelektrolízis Ke egyensúlyi állandójának a számértékét a víz standard keletkezési szabad entalpiájából ΔG°298(H2O), a következő egyenlet segítségével:
RTlnKe=2ΔG°298(H2O), könnyű kiszámítani.
Ez a bomlási reakció vízben analitikai módszerekkel nem észlelhető. Ha a hidrogénaktivitást [H2], mint koncentrációt értelmezzük, normális körülmények között 20.000 liter vízben egyetlen hidrogén molekula keletkezik. 1920-ban, amikor W.M. Clark a hidrogénaktivitáshoz kötött rH (ami ma rH2 néven ismert) fogalmát bevezette, pontosan ez az « analitikai » lehetetlenség késztette a korabeli vegyészeket az rH elmélet elvetésére. A kijelentés, ami szerint « egy elektróda potenciálját olyan hidrogén nem határozhatja meg, amelyik a vízben nem létezik », legalább 70 évre lezárta az elektrokémia egyik legtermékenyebb kutatási területét. Ezzel párhuzamosan a Ke egyensúlyi állandó igen alacsony számértékét is kifogásolták. Nem vették észre azt a tényt, hogy a kevésbé oldható elektrolitok ionszorzataiban ehhez hasonló igen kis értékek vannak.
Egy redukáló anyag vízben való feloldása elektronokat juttat a vízbe : növeli az elektronaktivitást. Az oxidáló anyagok ezzel szemben elektronokat vonnak el a vízből. Mindkét esetben a víz autoelektrolízis (5)-ös reakciójának az egyensúlyi helyzete változik. Redukáló anyagok jelenlétében a hidrogén aktivitása [H2] nő és az oxigéné [O2] csökken. Oxidáló anyagok hatása pontosan az ellenkező. Itt is az történik, mint a sav-bázis reakciók esetében, ahol [H+] és [OH–] ellentétes irányban változik.
Az rH2 fogalmát egy amerikai vegyész, W.M. Clark vezette be 1920-ban [3], pontosan 7 évvel a pH fogalmának a bevezetése után:
A kiegészítő fogalom az oxigén aktivitásához [O2] kötődik : rO2=-log[O2]. Ezek ismeretében a (6)-os egyenletet logaritmikus formában is leírhatjuk, minután pKe=-logKe:
Megjegyzés : a (8)-as egyenletnek a sav-bázis reakciók esetében a (3)-as egyenlet felel meg.
1920-ban Clark « rH »-ról beszélt. Az rH2 megjelölés, ami a valóságot jobban tükrözi, csak 1940 körül jelent meg Franciaországban. Clark az rH fogalmát, mint « a vízben lévő hidrogén nyomásának a negatív logaritmusát » definiálta : rH=-logPH2. Ekkor még a termodinamikai « aktivitás » fogalmát nem ismerték. A legtöbb szakkönyvben jelzett hidrogén elektróda potenciáljának Nernst-féle egyenlete E=(RT/2F)ln([H+]2/PH2) ennek következtében a dimenzió analízis szerint helytelen: a logaritmus függvény argumentumában nem egy dimenzió nélküli szám, hanem egy nyomás reciprok értéke van. A témakörben érdekes elolvasni Clark « perének » a rövid ismertetését.
A « redoxi semlegesség » avagy az « indifferens oldat » fogalma
A redoxi reakciók esetében is a standard, ill. « alapállapot » a vegytiszta víz, amiben a hidrogén [H2] és oxigén [O2] aktivitása az (5)-ös egyenlet értelmében 1:2 arányban oszlik meg : [H2] = 2 [O2]. Számítsuk ki ebből a tiszta víz rH2 értékét. Ehhez a (6)-os egyenletben helyettesítsük be [O2]-t, ½[H2]-vel:
Ebből már a tiszta víz hidrogénaktivitása kiszámítható : [H2] = 10-27,7, amit a vegyészek a gyakorlatban 10-28-ra kerekítenek le. A tiszta víz rH2 értéke tehát -log10-28=28. Ezt nevezik a vizes oldatok « redoxi semlegességi » pontjának, vagy « indifferens oldatnak ».
A pH értékétől teljesen függetlenül, egy olyan vizes oldat, amelyikben az rH2=28, sem oxidáló, sem redukáló (antioxidáns) vegyhatású. Amikor az rH2 0 és 28 között van, az oldat redukáló, vagy « antioxidáns ». Amikor az rH2 28 és 42 között van, oxidáló vegyhatású oldattal állunk szemben vegytiszta vízhez viszonyítva [4].
Élettani gyakorlatban a 0<rH2<28 értékű vizes oldatokban nemlélegző « anaerob » folyamatok mennek végbe. Itt az oxigénaktivitás alacsony. Nemlélegző közegben szaporodó baktériumok még vegyi redukcióra is képesek. Városi szennyvíztisztító állomásokon a fekália és a vizeletben lévő nitrogénben gazdag szerves anyagok oxidálása nyomán keletkezett nitrát ionokat, ezek a nemlélegző baktériumok egy külön tartályban elemi nitrogéngázra N2-re redukálják. Ezt nevezik « anaerob denitrifikációnak ». Ezekben a reaktorokban – bár nem mérik – de az rH2 értéke alacsony..
Amikor az rH2 28 és 42 között van, az oxigénaktivitás [O2] viszonylag magas, bár ez az érték az oldott oxigén koncentrációval egyáltalán nem áll arányban. Ilyen vizes közegben másfajta, un. lélegző (aerob) baktériumok kezdenek szaporodni. A valóságban minden mikro-organizmusnak (baktériumoknak, vírusoknak, gombáknak) megvan a maga sajátos rH2 és pH tartománya, amiben szaporodhat. Amint a vizes közeg pH és rH2 értéke ezeket a tartományokat elhagyja, az érintett mikro-organizmusok elpusztulnak. Amikor a vizes közeg rH2 értékét egy kétdimenziós koordináta rendszerben a pH függvényében ábrázoljuk, minden mikro-organizmus létezési tartományát fel lehet « térképezni ». Ezt a nevezik a « Vincent-féle diagramnak »![]() .
.
Ezzel az is érthetővé válik, hogy a vér rH2 értékének egy viszonylag csekély módosítása egyes baktériumok, vagy vírusok életfeltételeit teremti- vagy szünteti meg. A vér rH2 értéke a sejteken belül kialakuló elektromos potenciál különbségeket is szabályozza, ami behatással van a sejtek rendes, vagy rendellenes osztódására, azaz a rákos sejtek megjelenésére ill. eltűnésére.
A vizes oldatok stabilitási tartománya
Egy vizes oldatban ahol az oxigénaktivitás [O2] = 1, ott rO2=0 és a (8)-as egyenlet értelmében rH2=42. Ez a vizes oldatok termodinamikai stabilitásának a felső határa. Ezen az értéken a víz bomlásával oxigén O2 gáz keletkezhet, bár elektrolízis közben az anódon már aktív oxigénatomok O: is jelennek meg. Ezeket nevezik « születő oxigénnek », amelyekben az oxigén vegyi kötéseit létrehozó 6 elektron közül kettő nem párosított, tehát erősen reaktív. Az ilyen oxigénatom nem párosított elektronjait « szeretné párosítani », ugyanis ezzel egy 8 elektronból (négy párból) álló elektronszerkezetet hozhat létre, ami azonos a vegyileg igen stabilis neonéval : O2- (oxid) ion keletkezik. Az oxigén tulajdonképpen pontosan ezért oxidáló vegyhatású.
Egy vizes oldatban, ahol az rH2=0, a hidrogénaktivitás [H2]=1. EzEz a vizes oldatok termodinamikai stabilitásának az alsó határa. Ezen az értéken a víz bomlásával « születő hidrogén » H· keletkezik amelyik hidrogén gázzá alakulhat. Az ilyen, egy nem párosított elektronnal rendelkező, hidrogén igen reaktív, amelyik a szintén nem párosított elektronnal rendelkező szabad gyökökkel R· azonnal reakcióba lép. A σ (ejtsd « szigma ») kötéssel keletkezett új molekula H:R biológiailag többé nem aktív.
Negatív értékű rH2-nek a reverzibilis folyamatok termodinamikájában elvileg fizikai jelentése nincs. Egy ilyen oldatban a hidrogénaktivitás [H2]>1, amit hidrogén koncentrációval nehéz elképzelni. A gyakorlatban viszont már mértek negatív rH2 értékeket, amelyek termodinamikailag instabilis oldatoknak számítanak. Itt a születő hidrogén, egy más molekula szerkezetben, hidranion formájában H3O– stabilizálódik – legalább is ideiglenesen. Feltehetően ez történik az elektrolízissel készített hidrogénes vízben is.
A redoxi potenciál vagy ORP mérésének az első csapdája
A vizes oldatok redoxi tulajdonságait az ORP mérésével határozzák meg. Általánosan elfogadott vélemény szerint minél magasabb a mért ORP, az oldat annál oxidálóbb jellegű. Alacsonyabb, sőt negatív ORP értékekhez tartoznak a redukáló (antioxidáns) vizes közegek.
Egy millivoltmérőn leolvasott ORP értékről viszont azt is tudni kell, hogy :
- az nem annak a redoxi potenciálnak az értéke, amelyet elektrokémiai és termodinamikai számításokban felhasználnak; ezekhez a számításokhoz a műszeren olvasott értéket még korrigálni kell;
- még a korrigált ORP érték sem elegendő egy vizes oldat oxidáló ill. redukáló tulajdonságainak az egyértelmű meghatározására.
Vizsgáljuk meg az ORP mérések első « csapdáját », ami az leolvasott érték korrekciójához vezet.
Elektrokémiai szempontból a nulla redoxi potenciál nem a voltmérőn, leolvasott nulla érték. Az általánosan elfogadott véleménnyel ellentétben, a kísérleti ORP=0 millivolt egyáltalán nem a mért oldat redoxi semlegességi, ill. indifferencia pontja, ami alatt az oldat redukáló, felette pedig oxidáló (antioxidáns) tulajdonságú. A termodinamikai és elektrokémiai nulla potenciál annak a standard hidrogén elektródának a potenciálja, amelyikben az rH2=pH=0. Kísérleti szempontból a standard hidrogén elektróda nem más mint egy pH=0, erősen savas oldatba mártott platinaszivaccsal borított fémes platina elektróda, amelyikben egy bár nyomáson hidrogéngázt buborékoltatnak.
A standard hidrogén elektródába bevezetett hidrogén gáz a platinaszivacs likacsaiba adszorbeálódik és úgy viselkedik, mintha kondenzált halmazállapotban lenne. Ilyen halmazállapotban minden tiszta anyagnak az aktivitása egységnyi: az elektródában tehát [H2]=1, ami pontosan rH2=0-nak felel meg. Az ilyen körülmények között mért potenciál stabilis. Viszont a zéró értékét a klasszikus Nernst (11)sz. egyenletből vezetjük le, ugyanis ebben az esetben [H+]2/[H2]=1, aminek a logaritmusa viszont zéró [5]. Tehát a termodinamikai és az elektrokémiai zéró potenciálnak egy nagyon pontos fizikai jelentése van : értéke a minden vizes oldatban jelenlévő H2/H+ redoxi rendszerhez kötött rH2=pH=0 feltételnek engedelmeskedik.
Az elektrokémiai kézikönyvekben a standard hidrogénelektródával kapcsolatban csak a pH=0 feltételt említik és az « egy bár hidrogén nyomást » PH2=1. Ez utóbbi nem határozza meg a 0 potenciált. Amint azt már említettük, a Nernst egyenletbe vezetett [H+]2/PH2 hányad nem dimenzió nélküli szám hanem egy bár-1 dimenziójú mennyiség, aminek a logaritmusának fizikai jelentése nincs. A belső elméleti ellentmondás feloldására egy önkényes konvenciót kellett bevezetni, ami szerint itt a PH2, definíció szerint a hidrogénaktivitás, ami viszont fizikailag nem fedi a valóságot.
Ezt kísérletileg igen könnyű igazolni, ugyanis ha PH2=1bár egyenlő lenne az egységnyi hidrogénaktivitással, azaz [H2]=0-val, akkor egy platina hidrogén elektródában lévő, (pH=0) hidrogénnel telített oldatban is nulla potenciált kellene mérni. Ennek ellenőrzésére elegendő a hidrogéngázzal egy bár nyomáson telített pH=0 oldatba egy egyszerű fémes platina elektródát helyezni. Ezt a kísérletet 1992-ben a Mons-i Egyetemen elvégeztem. A mért potenciál +80mV körül állapodott meg, ami az oldatban rH2=3-nak felel meg. Ez egyáltalán nem meglepő, ugyanis ezen a nyomáson és 25°C-on a hidrogéngáz telítési koncentrációja 10-3 mol/liter, ami pontosan ennek az rH2 értéknek felel meg. Tehát 1 bár nyomáson, hidrogénnel telített vizes oldat hidrogénaktivitása nem egységnyi, azaz [H2]≠1, tehát rH2≠0. A nulla rH2 és a nulla potenciál elérésére a hidrogéngázt kondenzálni kell, amit egy bár nyomáson csak a platinaszivaccsal lehet megvalósítani. Ezért nem lehet a zéró potenciált az egy bár hidrogéngáz nyomáshoz kötni.
Összefoglalva : a standard platina elektróda zéró potenciálját nem az egy bár hidrogéngáz nyomáshoz, hanem a sokkal kézenfekvőbb és elméletileg is helyesebb pH=rH2=0 feltételhez kellene kötni.
(#orp_zero) Hibákhoz vezető félreértések elkerülése végett egyszer s mindenkorra jobb megjegyezni, hogy a műszeren leolvasott nulla potenciál a termodinamikai és elektrokémiai zéró potenciállal egyáltalán nem esik egybe. A mért ORP=0 nem felel meg a redoxi semlegességi pontnak, ami felett az oldat oxidáló és alatta pedig antioxidáns tulajdonságú.
Az ORP mérésére az oldatba tulajdonképpen két elektródát kell belemártani : egy fémes platina- és egy referencia elektródát. Ez utóbbinak a potenciálja állandó, stabilis és jól ismert érték, ami a vizsgált oldat tulajdonságaitól nem függ [6]. A valóságban tehát a két elektróda közötti potenciál különbséget mérjük és a műszeren egy ORP értéket olvasunk le, de nem a valós redoxi potenciált! A kereskedelemben kapható platina elektródákhoz, mint referenciát, egy ezüst/ezüst-klorid elektródot használnak, aminek a potenciálja a standard hidrogén elektródához képest +200mV=+0,2Volt. A platina elektróda az oldat potenciálját veszi fel, amíg a műszer a referencia elektródához viszonyított potenciál különbséget jelzi. A kijelzett számérték nem a valós ORP!
A kereskedelemben kapható platina elektródok tulajdonképpen « kombinált » elektródok, amelyekbe a platina mellé egy Ag/AgCl elektródát is beépítenek. Tehát az ORP mérése egy elektrokémiai elem elektromotoros erejének a mérésére korlátozódik.
Tulajdonképpen még a pH-t is egy kombinált elektródával mérik. Itt elektromotoros erő (potenciál különbség) az oldat pH értékétől függő üvegmembrán elektróda és egy Ag/AgCl elektróda között keletkezik.
Nincs tehát sem elvi, sem kísérleti különbség a pH és az rH2 mérése között. Mindkettőt egy-egy elektrokémiai elem elektromotoros erejével mérik. Ez a két, egymást kiegészítő változó a mért vizes oldat proton- és elektroncserés szintjét egyértelműen határozza meg. Az rH2 ismerete nélkül, az oldat redoxi tulajdonságainak a meghatározása nem egyértelmű.
Az rH2 kiszámítása a pH és a mért ORP értékekből
Az autoelektrolízissel kapcsolatban láttuk, hogy az oldat redoxi tulajdonságait egyértelműen csak az rH2 értéke határozza meg. A hidrogénaktivitás tulajdonképpen nem más, mint az oldat elektronaktivitása, ugyanis egy H2 molekula a víz egy-egy elektronjának, egy-egy protonra való átvitelével születik. A hidrogénaktivitás [H2] tehát az oldat elektronizálási mértékét fejezi ki. Viszont ebben a helyzetben felvetődik a kérdés : mi az ORP valós jelentése? Ezzel elérkezünk az ORP mérésének a második csapdájához.
Az ORP mérésének a második csapdája
A redoxi potenciált, vagy a valós ORP-t a klasszikus Nernst egyenlettel számítják ki a rendszer oxidált [Ox] és redukált [Red] formájának az aktivitásaiból. Minden redoxi rendszert egy redukáló fél-reakcióval jellemzik : Oxidált + n e– ![]() Redukált. Az oxidált forma n elektront vesz fel, amivel a redukált formává alakul. A vegyészek ezt a folyamatot a következő egyenlettel fejezik ki:
Redukált. Az oxidált forma n elektront vesz fel, amivel a redukált formává alakul. A vegyészek ezt a folyamatot a következő egyenlettel fejezik ki:
A (9)-es egyenlet megértéséhez vegyünk két példát. A klorid/klór Cl–/Cl2 redoxi rendszerben a redukáló fél-reakció : Cl2 + 2 e– ![]() 2 Cl-. A klór két elektron felvételével klorid ionokra redukálódik. Hasonlóan, az Na+/Na rendszerben a nátrium Na+ ionok elektron felvétellel fémes Na nátriumra redukálódnak : Na+ + e– → Na.
2 Cl-. A klór két elektron felvételével klorid ionokra redukálódik. Hasonlóan, az Na+/Na rendszerben a nátrium Na+ ionok elektron felvétellel fémes Na nátriumra redukálódnak : Na+ + e– → Na.
Nagyon lényeges tény az, hogy a töltésátviteli folyamatokban a víz egy aktív oldószer : bázisok jelenlétében savként viselkedik, savakkal szemben pedig mint egy bázis. Ezt nevezik a víz amfoter, jellegének. A víz, az elektronátviteli folyamatokban is pontosan így viselkedik : redukáló szerek jelenlétében oxidál, elektronokat vesz fel, oxidáló szereket viszont elektronok átadásával bizonyos mértékig redukálja.
A víz tehát maga is egy redoxi rendszer, amelyik az oldott anyagoknak elektronokat képes adni és azoktól elvenni. A víz redoxi rendszere nem más, mint a hidrogén/proton H2/H+ rendszer. Amelyet a következő redukáló fél-reakcióval jellemeznek:
Ennek a rendszernek az oxidált formája a proton H+ (vagy annak a hidrolizált változata a hidroxonimum ion H3O+), a redukált forma a hidrogén H2. Érdekes megjegyezni, hogy pontosan ez a redoxi rendszer működteti a standard hidrogénelektródát is amihez az ORP termodinamikai skáláját is kötik. Ebben az értelemben minden vizes oldat, bármilyen legyen is a vegyi összetétele, egy hidrogénelektróda elektrolitjának tekinthető. Ez képezi a bioelektronika első főtételét. Bármilyen vizes oldatba mártott platina (vagy más fémes, az oldattal nem reagáló elektróda) potenciálját csak a vízben lévő protonaktivitás [H+] és elektronaktivitás [H2] számértéke határozza meg. Tehát, bármi legyen is az oldat összetétele, a fémes (platina) elektróda erre a két aktivitásra érzékeny lesz. Az is igaz viszont, hogy a proton- és elektronaktivitás mértékét a vízben oldott anyagok határozzák meg.
Tehát minden vizes oldatra a következő Nernst egyenlet érvényes: (#nernst)
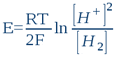
...ahol E a valós (korrigált) ORP; R = 8,316 Joule/mol.K (egyetemes gázállandó); T az abszolút hőmérséklet Kelvin fokban kifejezve (25°C = 298K); és F = 96500 Coulomb/mol (Faraday állandó, avagy egy mol elektron elektromos töltése). Tízes alapú logaritmusokra áttérve (lnx = 2,303logx), valamint a pH és az rH2 definícióját figyelembe véve a (11)-es egyenlet a következő formát veszi fel:
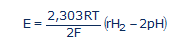
...vagy
A (13)-as egyenlet mutatja, és fejezi ki matematikailag az ORP mérésének a második csapdáját [7]. A redoxi potenciál E (vagy a valós ORP) két fizikai különböző nagyság algebrai összege. A (13)-as egyenlet jobb oldalának az első tagja csak az elekroncserés folyamatoktól függ, amit az rH2 jellemez. A második tag csak a protoncserés reakciók mértékét fejezi ki, amit a pH-val mérnek. A voltmérőn leolvasott és korrigált E, vagy (ORP) redoxi potenciál nemcsak az oldat redoxi, hanem a sav-bázis tulajdonságaitól is függ. Tehát az oldat oxidáló vagy redukáló (antioxidáns) tulajdonságait csak az ORP alapján, meghatározni, hibás értékeléshez vezet.
A (13)-as egyenlet ismeretében az a kijelentés, ami szerint « az rH2 nem létezik, ugyanis az csak két kísérleti nagyság a potenciál és a pH önkényes lineáris kombinációja » eléggé különös. Ez annál is inkább elfogadhatatlan, hogy a pH és az rH2 mérése azonos elméleti és gyakorlati alapokon nyugszik : egy elem elektromotoros erejének a mérésén. Ezzel a logikával azt is ki lehetne jelenteni, « hogy a pH sem létezik, ugyanis az két független kísérleti nagyság a potenciál és az rH2 önkényes lineáris kombinációja ».
Az rH2 kiszámításának a gyakorlati képlete
Azt a tényt figyelembe véve, ami szerint T=25°C=298K-on 2F/2,303RT = 33,8 a (13)-as egyenletből az rH2 kiszámításának a gyakorlati képletét kapjuk :
...ebben az egyenletben E nem más mint a korrigált ORP, Volt-ban kifejezve.
Fontos megjegyzés:
A (14)-es képlet alkalmazásakor a voltmérőn leolvasott ORP értékéhez a használt referencia elektróda potenciálját is hozzá kell adni. Ag/AgCl (ezüst/ezüst-klorid) elektróda esetében a korrekciós érték +200mV = +0,2 Volt.
Példák az rH2 kiszámítására. Számítsuk ki a « Dasani » ásványvíz rH2 értékét, ahol a pH=3,04 és a műszeren olvasott ORP=+290mV. Ebben az esetben a redoxi potenciál E=290+200=490mV=0,49Volt amit a (14)-es képletbe beírva az rH2-t a következő egyszerű számítás adja meg :
Erősen savas jellegének ellenére, a « Dasani » ásványvíz határozottan redukáló « antioxidáns » kémhatású víz, miután rH2 értéke 28 alatt van.
Vizsgáljuk meg egy erősen bázikus ásványvíz esetét is. A bázikus vizek ORP értéke, pontosan bázikus jellegük miatt, mindig alacsony. Az ilyen ORP érték miatt, a lúgos vizeket sok esetben az « antioxidáns » osztályba sorolják, mint pl. az « Essentia » ásványvizet is. Ebben a vízben a pH=9,26, a mért ORP=+179mV. Számítsuk ki az rH2 értéket :
Amint azt már kifejtettük, amikor egy víz rH2 értéke 28 felett van, oxidáló vízről beszélhetünk. Ilyen pl. a klórral fertőtlenített csapvíz is.
Csak a mért ORP alapján a +290mV-os Dasani vizet « oxidáló, a +179mV-os Essentia vizet pedig a kevésbé oxidáló osztályba sorolták volna. Elektrokémiai számítás szerint ennek az ellenkezője az igaz: a savas Dasani víz a valóságban anti-oxidáns, amíg a lúgos Essentia határozottan oxidáló vegyhatású víz.
A Vincent-féle W energia tényező
Az orvosi bioelektronikában, a Louis-Claude Vincent által 1973-ban javasolt energia tényező fontos szerepet játszik. A bioelektronikai koordinátákra alapozott tényezőt Vincent « az élő szervezetben lévő energia tartalékok » és « a szervezet energia termelésének a sebességének » a kiszámítására javasolta. Ennek érdekében az E redoxi potenciálból és a ρ fajlagos ellenállásból, az energiatermelés kiszámítására, a hagyományos elektrotechnika módszereit alkalmazta.
Egy teljesen empirikus tényezőről van itt szó, aminek a fizikai jelentését, még Vincent sem tartotta érdemesnek meghatározni. Bár az orvosi gyakorlatban a W tényező, összehasonlításokra hasznosnak bizonyult, Vincent követői körében a W fizikai jelentésének a meghatározására egyre egyre nagyobb szükség volt. Ennek érdekében, 1992-ben, egy dolgozatban próbáltunk a Vincent-féle energia tényezőt egy termodinamikai model segítségével megmagyarázni. [Forrás: Országh J. « Quelques aspects physico-chimiques des coordonnées bio-électroniques », Sciences du Vivant (Arys Kiadó, Paris), 4. kötet, 45-62 old. (1992)].
Minden redoxi rendszert egy standard hidrogénelektródából és a rendszert tartalmazó elektródából elméletileg összeállított elem segítségével lehet modellizálni. Ennek az elemnek az elektromotoros ereje E, ami az elemet hajtó reakció szabad entalpiával ΔG°298 egyenesen arányos. Szabványosítás érdekében [8], ennek az elemnek egy olyan részét vesszük, amiben az ℓ=1cm távolságban elhelyezett elektródák felszíne s=1cm2, a benne lévő 1cm³ elektrolit fajlagos ellenállása pedig ρ (ejtsd: ró). Ennek az elemnek a teljesítménye W a következő képlettel számítható ki:
ahol k=s/ℓ (azaz 1cm²/cm), egy állandó, aminek a számértéke, szabványosan 1. Amikor az elektromotoros erőt E-t millivoltban (mV) fejezzük ki, a E fajlagos ellenállást pedig ohm.cm-ben, akkor a teljesítményt mikrowattban (µW) kapjuk meg. A számított érték ennek az elméleti elemnek a maximális teljesítménye.
Bár Vincent tudományos közleményeiben ez a szabvány nem szerepel, hallgatólagosan jelen van. A k=s/ℓ állandó bevezetése nélkül a Vincent által javasolt W=E2/ρ képlet dimenzióanalízis szerint helytelen. Az k=1-es számérték Vincent képletének a gyakorlati értékét megtartja.
A (15)-ös képlet E értékét helyettesítsük a (14)-es képletből számított E értékkel, figyelembe véve azt is, hogy k=1cm²/cm :
A kapott 8,75.10-4 állandó, csak 25°C-on érvényes. Más, T hőmérsékleten, 33,8-at más számértékkel kel helyettesíteni, amit 2F/2,303RT képlet segítségével bárki könnyen kiszámíthat.
A laboratóriumi gyakorlatban a fajlagos ellenállás helyett a mérőműszerek a fajlagos vezetőképességet κ (ejtsd : kappa) mérik. Ez utóbbi a fajlagos ellenállás reciprok értéke : κ=1/ρ. A fajlagos vezetőképességet µS/cm-ben (ejtsd « microSiemens per cm ») fejezik ki. A következő gyakorlati képletben, a W értékét µW-ban (microwatt) kapjuk.
Példák, a W kiszámítására. Legyen egy városi vezetékes víz, ahol κ = 650 µS/cm, rH2 = 30,5 és a pH = 7,6. Ennek a víznek az energia tényezője:
Hasonlítsuk össze egy betontárolóból kiemelt esővíz W értékével. Itt κ = 35 µS/cm, rH2 = 28,5 és pH= 7,2. Az energia tényező tehát:
jóval alacsonyabb, mint a városi víz esetén.
A fogyasztásra termelt « ivóvíz szabványok » mellett az un. « éltető minőségű » víz előírásaiban (amelyik nem szabvány, csupán javaslat) a W értéke is szerepel. Ezeket az előírásokat a tárgykörrel foglalkozó fejezet táblázatában láthatjuk.




